Kao što već znamo, unutrašnja energija tijela može se mijenjati i tokom rada i prijenosom topline (bez obavljanja posla). Glavna razlika između rada i količine toplote je u tome što rad određuje proces pretvaranja unutrašnje energije sistema, koji je praćen transformacijom energije iz jedne vrste u drugu.
U slučaju da dođe do promjene unutrašnje energije uz pomoć prijenos topline, prijenos energije s jednog tijela na drugo vrši se zbog toplotna provodljivost, zračenje, ili konvekcija.
Energija koju tijelo gubi ili dobije tokom prijenosa topline naziva se količinu toplote.
Prilikom izračunavanja količine toplote, morate znati koje količine na nju utiču.
Zagrijati ćemo dvije posude pomoću dva identična plamenika. Jedna posuda sadrži 1 kg vode, druga 2 kg. Temperatura vode u dvije posude je u početku ista. Vidimo da se za isto vreme voda u jednoj posudi brže zagreva, iako obe posude dobijaju podjednako količina toplote.
Dakle, zaključujemo: što je veća masa datog tijela, to je veća količina topline koja se mora potrošiti da bi se njegova temperatura snizila ili povećala za isti broj stupnjeva.
Kada se tijelo ohladi, ono odaje veću količinu topline susjednim objektima, što je veća njegova masa.
Svi znamo da ako trebamo zagrijati pun kotlić vode na temperaturu od 50°C, potrošit ćemo manje vremena na ovu radnju nego da zagrijemo kotlić sa istom zapreminom vode, ali samo na 100°C. U slučaju broj jedan, vodi će se dati manje topline nego u slučaju dva.
Dakle, količina topline potrebna za grijanje direktno ovisi o tome da li koliko stepeni tijelo se može zagrijati. Možemo zaključiti: količina toplote direktno zavisi od razlike u telesnoj temperaturi.
Ali je li moguće odrediti količinu topline koja je potrebna ne za zagrijavanje vode, već neke druge tvari, recimo ulja, olova ili željeza?
 Napunite jednu posudu vodom, a drugu napunite biljnim uljem. Mase vode i ulja su jednake. Zagrijati ćemo obje posude ravnomjerno na identičnim gorionicima. Započnimo eksperiment na jednakim početnim temperaturama biljnog ulja i vode. Pet minuta kasnije, nakon mjerenja temperature zagrijanog ulja i vode, primijetit ćemo da je temperatura ulja mnogo viša od temperature vode, iako su obje tekućine dobile istu količinu topline.
Napunite jednu posudu vodom, a drugu napunite biljnim uljem. Mase vode i ulja su jednake. Zagrijati ćemo obje posude ravnomjerno na identičnim gorionicima. Započnimo eksperiment na jednakim početnim temperaturama biljnog ulja i vode. Pet minuta kasnije, nakon mjerenja temperature zagrijanog ulja i vode, primijetit ćemo da je temperatura ulja mnogo viša od temperature vode, iako su obje tekućine dobile istu količinu topline.
Očigledan zaključak je: Prilikom zagrijavanja jednake mase ulja i vode na istoj temperaturi, potrebne su različite količine topline.
I odmah izvlačimo drugi zaključak: količina topline potrebna za zagrijavanje tijela direktno ovisi o tvari od koje se sastoji samo tijelo (vrsta tvari).
Dakle, količina topline potrebna za zagrijavanje tijela (ili oslobođena pri hlađenju) direktno ovisi o masi tijela, varijabilnosti njegove temperature i vrsti tvari.
Količina toplote je označena simbolom Q. Kao i drugi različite vrste energije, količina toplote se meri u džulima (J) ili kilodžulima (kJ).
1 kJ = 1000 J
Međutim, istorija pokazuje da su naučnici počeli da mere količinu toplote mnogo pre nego što se koncept energije pojavio u fizici. U to vrijeme razvijena je posebna jedinica za mjerenje količine topline - kalorija (cal) ili kilokalorija (kcal). Riječ ima latinske korijene, calor - toplina.
1 kcal = 1000 cal
Kalorija– ovo je količina topline potrebna za zagrijavanje 1 g vode za 1°C
1 kal = 4,19 J ≈ 4,2 J
1 kcal = 4190 J ≈ 4200 J ≈ 4,2 kJ
Imate još pitanja? Ne znate kako da uradite domaći?
Da biste dobili pomoć od tutora, registrujte se.
Prva lekcija je besplatna!
web stranicu, kada kopirate materijal u cijelosti ili djelomično, link na izvor je obavezan.
Uz mehaničku energiju, svako tijelo (ili sistem) ima unutrašnju energiju. Unutrašnja energija je energija odmora. Sastoji se od termičkog haotičnog kretanja molekula koji čine tijelo, potencijalne energije njihovog međusobnog rasporeda, kinetičke i potencijalne energije elektrona u atomima, nukleona u jezgrama itd.
U termodinamici je važno znati ne apsolutnu vrijednost unutrašnje energije, već njenu promjenu.
U termodinamičkim procesima mijenja se samo kinetička energija pokretnih molekula (toplotna energija nije dovoljna za promjenu strukture atoma, a još manje jezgra). Stoga, u stvari pod unutrašnjom energijom u termodinamici mislimo na energiju termički haotičan molekularna kretanja.
Unutrašnja energija U jedan mol idealnog gasa jednak je:
dakle, unutrašnja energija zavisi samo od temperature. Unutrašnja energija U je funkcija stanje sistema, bez obzira na pozadinu.
Jasno je da u opšti slučaj termodinamički sistem može imati i unutrašnju i mehaničku energiju, i različiti sistemi mogu razmjenjivati ove vrste energije.
Razmjena mehanička energija karakteriše savršeno rad A, i razmena unutrašnje energije – količina prenešene toplote Q.
Na primjer, zimi ste bacili vrući kamen u snijeg. Zbog rezerve potencijalne energije, mehanički rad drobljenjem snijega, a zbog rezerve unutrašnje energije snijeg je otopljen. Ako je kamen bio hladan, tj. Ako je temperatura kamena jednaka temperaturi medija, tada će se obavljati samo rad, ali neće doći do izmjene unutrašnje energije.
Dakle, rad i toplina nisu posebne forme energije. Ne možemo govoriti o rezervi toplote ili rada. Ovo mjera prenesenog drugi sistem mehaničke ili unutrašnje energije. Možemo govoriti o rezervi ovih energija. Osim toga, mehanička energija se može pretvoriti u toplinsku energiju i obrnuto. Na primjer, ako čekićem udarite u nakovanj, onda će se nakon nekog vremena čekić i nakovanj zagrijati (ovo je primjer rasipanje energija).
Možemo dati još mnogo primjera transformacije jednog oblika energije u drugi.
Iskustvo pokazuje da u svim slučajevima, Transformacija mehaničke energije u toplotnu i obrnuto uvijek se događa u strogo ekvivalentnim količinama. Ovo je suština prvog zakona termodinamike, koji slijedi iz zakona održanja energije.
Količina toplote koja se prenosi telu ide za povećanje unutrašnje energije i za obavljanje rada na telu:
| , | (4.1.1) |
- To je ono prvi zakon termodinamike , ili zakon održanja energije u termodinamici.
Pravilo potpisa: ako se toplota prenosi sa okruženje ovaj sistem, i ako sistem obavlja rad na okolnim tijelima, u ovom slučaju . Uzimajući u obzir pravilo predznaka, prvi zakon termodinamike može se zapisati kao:
U ovom izrazu U– funkcija stanja sistema; d U je njegov ukupni diferencijal, a δ Q i δ A oni nisu. U svakom stanju sistem ima određenu i samo ovu vrijednost unutrašnje energije, pa možemo napisati:
 , ,
|
Važno je napomenuti da toplota Q i rad A zavisi od toga kako je ostvaren prijelaz iz stanja 1 u stanje 2 (izohorijski, adijabatski, itd.), i unutrašnje energije U ne zavisi. Istovremeno, ne može se reći da sistem ima specifičnu vrijednost toplote i rada za dato stanje.
Iz formule (4.1.2) proizilazi da se količina toplote izražava u istim jedinicama kao rad i energija, tj. u džulima (J).
Od posebnog značaja u termodinamici su kružni ili ciklični procesi u kojima se sistem, nakon što prođe kroz niz stanja, vraća u prvobitno stanje. Slika 4.1 prikazuje ciklički proces 1– A–2–b–1, dok je posao A obavljen.

Rice. 4.1
Jer U je onda funkcija stanja
| (4.1.3) |
To vrijedi za bilo koju državnu funkciju.
Ako onda prema prvom zakonu termodinamike, tj. Nemoguće je izgraditi periodično radni motor koji bi obavljao više posla od količine energije koja mu se prenosi izvana. Drugim riječima, vječni motor prve vrste je nemoguć. Ovo je jedna od formulacija prvog zakona termodinamike.
Treba napomenuti da prvi zakon termodinamike ne pokazuje u kom pravcu se odvijaju procesi promene stanja, što je jedan od njegovih nedostataka.
>>Fizika: Količina toplote
Unutrašnju energiju plina u cilindru možete promijeniti ne samo radom, već i zagrijavanjem plina.
Ako popravite klip ( Fig.13.5), tada se zapremina gasa ne menja pri zagrevanju i ne obavlja se nikakav rad. Ali temperatura plina, a time i njegova unutrašnja energija, raste.
Proces prijenosa energije s jednog tijela na drugo bez vršenja rada naziva se izmjena toplote ili prijenos topline.
Kvantitativna mjera promjene unutrašnje energije tokom prijenosa topline naziva se količinu toplote. Količina toplote se naziva i energija koju telo odaje tokom razmene toplote.
Molekularna slika prijenosa topline
Pri razmeni toplote energija se ne pretvara iz jednog oblika u drugi, već se deo unutrašnje energije toplog tela prenosi na hladno telo.
Količina topline i toplinski kapacitet. To već znate za zagrijavanje tijela mase m na temperaturi t 1 do temperature t 2 na njega je potrebno prenijeti količinu topline:
Kada se tijelo ohladi, njegova konačna temperatura je t 2 ispada da je manja od početne temperature t 1 a količina toplote koju odaje tijelo je negativna.
Koeficijent c u formuli (13.5) se zove specifični toplotni kapacitet
supstance. Specifična toplota- to je količina koja je brojčano jednaka količini topline koju prima ili oslobađa tvar težine 1 kg kada se njena temperatura promijeni za 1 K.
Specifični toplinski kapacitet ovisi ne samo o svojstvima tvari, već io procesu kojim se odvija prijenos topline. Ako zagrijete plin pri konstantnom pritisku, on će se proširiti i obaviti rad. Da bi se gas zagrejao za 1°C pri konstantnom pritisku, potrebno je da prenese više toplote nego da ga zagreje pri konstantnoj zapremini, kada će se gas samo zagrejati.
Tečnost i čvrste materije lagano proširiti kada se zagrije. Njihovi specifični toplotni kapaciteti pri konstantnoj zapremini i konstantnom pritisku se malo razlikuju.
Specifična toplota isparavanja. Da bi se tečnost pretvorila u paru tokom procesa ključanja, mora joj se preneti određena količina toplote. Temperatura tečnosti se ne menja kada proključa. Transformacija tekućine u paru pri konstantnoj temperaturi ne dovodi do povećanja kinetičke energije molekula, već je praćena povećanjem potencijalne energije njihove interakcije. Na kraju krajeva, prosječna udaljenost između molekula plina je mnogo veća nego između molekula tekućine.
Količina numerički jednaka količini toplote koja je potrebna da se tečnost mase 1 kg pretvori u paru pri konstantnoj temperaturi naziva se specifična toplota isparavanje. Ova vrijednost je označena slovom r i izraženi su u džulima po kilogramu (J/kg).
Specifična toplota isparavanja vode je veoma visoka: r H2O=2,256 10 6 J/kg na temperaturi od 100°C. Za druge tekućine, na primjer alkohol, etar, živu, kerozin, specifična toplina isparavanja je 3-10 puta manja od vode.
Za pretvaranje tečnosti u masu m za paru je potrebna količina toplote jednaka:
Kada se para kondenzuje, oslobađa se ista količina toplote:
Vrijednost numerički jednaka količini topline koja je potrebna za transformaciju kristalne tvari težine 1 kg na tački taljenja u tekućinu naziva se specifična toplina fuzije.
Kada kristalizuje supstanca mase 1 kg, oslobađa se tačno ista količina toplote koja se apsorbuje tokom topljenja.
Specifična toplota topljenja leda je prilično visoka: 3,34 10 5 J/kg. „Ako led nije imao veliku toplotu fuzije“, pisao je R. Black još u 18. veku, „onda bi se u proleće cela masa leda trebala otopiti za nekoliko minuta ili sekundi, pošto se toplota neprekidno prenosi na led iz vazduha. Posljedice ovoga bi bile strašne; na kraju krajeva, čak iu sadašnjoj situaciji, velike poplave i jaki tokovi vode nastaju kada se tope velike mase leda ili snijega.”
Da bi se rastopilo kristalno tijelo vaganje m, potrebna količina toplote je jednaka:
Količina toplote koja se oslobađa tokom kristalizacije tela jednaka je:
Unutrašnja energija tijela mijenja se tokom zagrijavanja i hlađenja, tokom isparavanja i kondenzacije, tokom topljenja i kristalizacije. U svim slučajevima, određena količina topline se prenosi ili uklanja iz tijela.
???
1. Šta se zove količina toplina?
2. Od čega zavisi specifični toplotni kapacitet supstance?
3. Šta se zove specifična toplota isparavanja?
4. Kako se zove specifična toplota fuzije?
5. U kojim slučajevima je količina toplote pozitivna veličina, a u kojim negativna?
G.Ya.Myakishev, B.B.Bukhovtsev, N.N.Sotsky, Fizika 10. razred
Sadržaj lekcije beleške sa lekcija podrška okvirnoj prezentaciji lekcija metode ubrzanja interaktivne tehnologije Vježbajte zadaci i vježbe radionice za samotestiranje, obuke, slučajevi, potrage domaća zadaća diskusija pitanja retorička pitanja učenika Ilustracije audio, video i multimedija fotografije, slike, grafike, tabele, dijagrami, humor, anegdote, vicevi, stripovi, parabole, izreke, ukrštene reči, citati Dodaci sažetakačlanci trikovi za radoznale jaslice udžbenici osnovni i dodatni rječnik pojmova ostalo Poboljšanje udžbenika i lekcijaispravljanje grešaka u udžbeniku ažuriranje fragmenta u udžbeniku, elementi inovacije u lekciji, zamjena zastarjelog znanja novim Samo za nastavnike savršene lekcije kalendarski plan za godinu smjernice diskusioni programi Integrisane lekcijeAko imate ispravke ili prijedloge za ovu lekciju,
730. Zašto se voda koristi za hlađenje nekih mehanizama?
Voda ima visok specifični toplinski kapacitet, što omogućava dobro odvođenje topline iz mehanizma.
731. U kom slučaju je potrebno potrošiti više energije: zagrijati jedan litar vode za 1 °C ili zagrijati sto grama vode za 1 °C?
Za zagrijavanje litre vode, što je veća masa, potrebno je potrošiti više energije.
732. Kupronikl srebro i srebrne viljuške jednake mase spuštene su u vruću vodu. Hoće li dobiti istu količinu toplote iz vode?
Viljuška bakronikla će dobiti više toplote jer je specifična toplota bakronikla veća od one srebra.
733. Komad olova i komad lijevanog željeza iste mase udareni su tri puta maljem. Koji komad je postao topliji?
Olovo će se zagrijati više jer je njegov specifični toplinski kapacitet manji od lijevanog željeza i potrebno je manje energije za zagrijavanje olova.
734. Jedna boca sadrži vodu, druga kerozin iste mase i temperature. Jednako zagrijana gvozdena kocka stavljena je u svaku tikvicu. Šta će se zagrijati na višu temperaturu - voda ili kerozin?
Kerozin.
735. Zašto su fluktuacije temperature zimi i ljeti manje oštre u gradovima na obali mora nego u gradovima koji se nalaze u unutrašnjosti?
Voda se sporije zagrijava i hladi od zraka. Zimi hladi i premešta tople vazdušne mase na kopno, čineći klimu na obali toplijom.
736. Specifični toplotni kapacitet aluminijuma je 920 J/kg °C. Šta to znači?
To znači da je za zagrijavanje 1 kg aluminija za 1 °C potrebno potrošiti 920 J.
737. Aluminijumske i bakrene šipke iste mase 1 kg hlade se za 1 °C. Koliko će se promijeniti unutrašnja energija svakog bloka? Za koju traku će se više promijeniti i za koliko?
738. Kolika je količina topline potrebna da se kilogram gvozdene gredice zagrije za 45 °C?

739. Kolika je količina toplote potrebna da se 0,25 kg vode zagrije sa 30 °C na 50 °C?
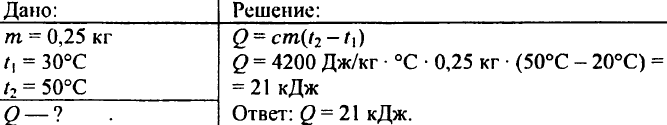
740. Kako će se promijeniti unutrašnja energija dvije litre vode kada se zagrije za 5 °C?

741. Kolika je količina topline potrebna da se 5 g vode zagrije sa 20 °C na 30 °C?

742. Kolika je količina topline potrebna da se aluminijska kugla mase 0,03 kg zagrije za 72 °C?

743. Izračunaj količinu topline koja je potrebna da se 15 kg bakra zagrije za 80 °C.
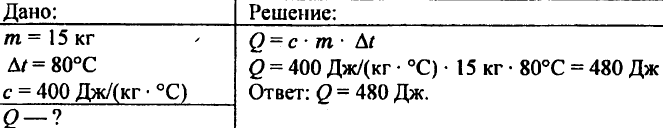
744. Izračunaj količinu topline koja je potrebna za zagrijavanje 5 kg bakra od 10 °C do 200 °C.

745. Kolika je količina toplote potrebna da se 0,2 kg vode zagrije sa 15 °C na 20 °C?

746. Voda mase 0,3 kg ohladila se za 20 °C. Koliko se smanjila unutrašnja energija vode?

747. Kolika je količina toplote potrebna da se 0,4 kg vode na temperaturi od 20 °C zagrije na temperaturu od 30 °C?

748. Kolika se količina topline utroši da se 2,5 kg vode zagrije za 20 °C?

749. Kolika se količina toplote oslobodila kada se 250 g vode ohladilo sa 90 °C na 40 °C?

750. Koja je količina topline potrebna da bi se 0,015 litara vode zagrijalo za 1 °C?

751. Izračunajte količinu topline koja je potrebna za zagrijavanje jezera zapremine 300 m3 za 10 °C?

752. Koju količinu toplote treba dodati 1 kg vode da bi se temperatura povećala sa 30 °C na 40 °C?

753. Voda zapremine 10 litara se ohladila sa temperature od 100 °C na temperaturu od 40 °C. Koliko je topline oslobođeno pri tome?

754. Izračunajte količinu topline koja je potrebna da se 1 m3 pijeska zagrije za 60 °C.

755. Zapremina vazduha 60 m3, specifični toplotni kapacitet 1000 J/kg °C, gustina vazduha 1,29 kg/m3. Koliko je toplote potrebno da se temperatura podigne na 22°C?

756. Voda je zagrijana za 10 °C, utrošivši 4,20 103 J topline. Odredite količinu vode.

757. Vodi težine 0,5 kg preneseno je 20,95 kJ topline. Kolika je postala temperatura vode ako je početna temperatura vode bila 20 °C?
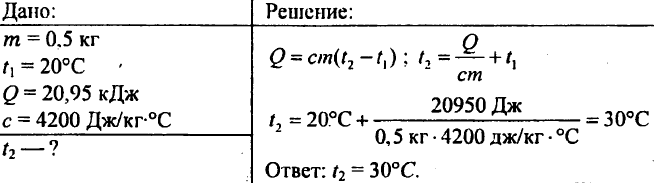
758. Bakarna posuda od 2,5 kg napunjena je sa 8 kg vode na 10 °C. Koliko je toplote potrebno da se voda u tiganju zagreje do ključanja?

759. Litar vode temperature 15 °C sipa se u bakarnu kutlaču mase 300 g. Kolika je količina toplote potrebna da bi se voda u kutlači zagrejala na 85 °C?

760. Komad ugrijanog granita težine 3 kg stavlja se u vodu. Granit prenosi 12,6 kJ toplote na vodu, hladeći se za 10 °C. Koliki je specifični toplotni kapacitet kamena?
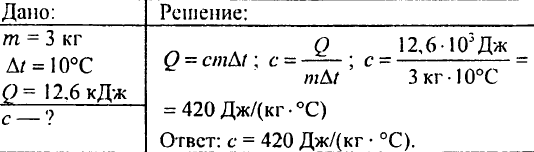
761. Vruća voda na 50 °C dodana je u 5 kg vode na 12 °C, dajući smjesu s temperaturom od 30 °C. Koliko vode ste dodali?

762. Voda na 20 °C dodana je u 3 litre vode na 60 °C, dajući vodu na 40 °C. Koliko vode ste dodali?

763. Kolika će biti temperatura smjese ako pomiješate 600 g vode na 80 °C sa 200 g vode na 20 °C?

764. Litar vode temperature 90 °C uliven je u vodu temperature 10 °C, a temperatura vode je postala 60 °C. Koliko ih je bilo hladnom vodom?

765. Odredite koliko tople vode zagrijane na 60 °C treba uliti u posudu ako se u posudi već nalazi 20 litara hladne vode temperature 15 °C; temperatura smeše treba da bude 40 °C.
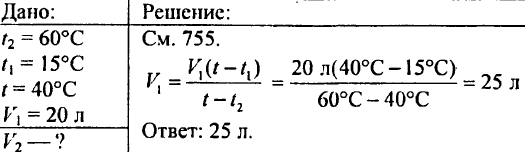
766. Odredi koliko je topline potrebno da se 425 g vode zagrije za 20 °C.

767. Za koliko stepeni će se zagrijati 5 kg vode ako voda primi 167,2 kJ?

768. Koliko je topline potrebno za zagrijavanje m grama vode na temperaturi t1 na temperaturu t2?
769. 2 kg vode se sipa u kalorimetar na temperaturi od 15 °C. Do koje temperature će se zagrijati voda kalorimetra ako se u nju spusti mjedeni uteg od 500 g zagrijan na 100 °C? Specifični toplotni kapacitet mesinga je 0,37 kJ/(kg °C).

770. Ima komada bakra, kalaja i aluminijuma iste zapremine. Koji od ovih komada ima najveći, a koji najmanji toplinski kapacitet?

771. U kalorimetar je sipano 450 g vode, čija je temperatura bila 20 °C. Kada se 200 g željeznih strugotina zagrijanih na 100 °C uroni u ovu vodu, temperatura vode je postala 24 °C. Odredite specifični toplinski kapacitet piljevine.

772. Bakarni kalorimetar mase 100 g sadrži 738 g vode čija je temperatura 15 °C. U ovaj kalorimetar spušteno je 200 g bakra na temperaturi od 100 °C, nakon čega je temperatura kalorimetra porasla na 17 °C. Koliki je specifični toplotni kapacitet bakra?
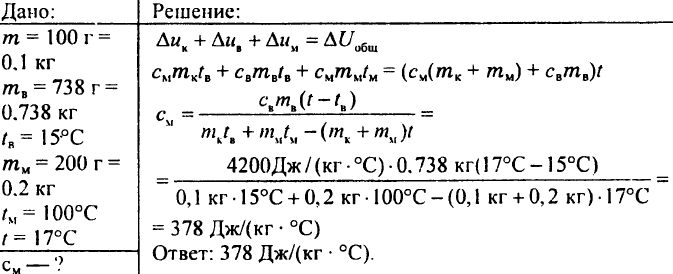
773. Čelična kugla mase 10 g izvadi se iz rerne i stavi u vodu na temperaturi od 10 °C. Temperatura vode porasla je na 25 °C. Kolika je bila temperatura kuglice u pećnici ako je masa vode bila 50 g? Specifični toplinski kapacitet čelika je 0,5 kJ/(kg °C).

777. U vodu mase 150 g na temperaturi od 35 °C sipano je 50 g vode temperature 19 °C. Kolika je temperatura smjese?

778. Voda težine 5 kg na 90 °C sipana je u lonac od livenog gvožđa od 2 kg na temperaturi od 10 °C. Kolika je bila temperatura vode?

779. Čelični rezač mase 2 kg zagrijan je na temperaturu od 800 °C, a zatim spušten u posudu od 15 litara vode na temperaturi od 10 °C. Do koje temperature će se zagrijati voda u posudi?

(Indikacija: Za rješavanje ovog problema potrebno je napraviti jednačinu u kojoj se nepoznata temperatura vode u posudi nakon spuštanja rezača uzima kao nepoznata.)
780. Koju će temperaturu dobiti voda ako pomiješate 0,02 kg vode na 15 °C, 0,03 kg vode na 25 °C i 0,01 kg vode na 60 °C?

781. Za grijanje klase sa dobrom ventilacijom potrebna je količina toplote 4,19 MJ na sat. Voda ulazi u radijatore grijanja na 80 °C i izlazi iz njih na 72 °C. Koliko vode treba dopremati radijatorima svakog sata?

782. Olovo mase 0,1 kg na temperaturi od 100 °C potopljeno je u aluminijumski kalorimetar težine 0,04 kg koji sadrži 0,24 kg vode na temperaturi od 15 °C. Nakon toga je temperatura u kalorimetru dostigla 16 °C. Koja je specifična toplota olova?

Šta će se brže zagrijati na šporetu - čajnik ili kanta vode? Odgovor je očigledan - čajnik. Onda je drugo pitanje zašto?
Odgovor nije ništa manje očigledan - jer je masa vode u čajniku manja. Odlično. A sada možete i sami da uradite pravu stvar fizičko iskustvo kod kuce. Za to će vam trebati dvije identične male šerpe, jednak iznos voda i biljno ulje, na primjer, pola litre i šporet. Stavite lonce sa uljem i vodom na istu vatru. Sada samo gledajte šta će se brže zagrijati. Ako imate termometar za tekućine, možete ga koristiti; ako nemate, možete jednostavno s vremena na vrijeme provjeriti temperaturu prstom, samo pazite da se ne opečete. U svakom slučaju, uskoro ćete vidjeti da se ulje zagrijava mnogo brže od vode. I još jedno pitanje, koje se također može implementirati u obliku iskustva. Šta će brže ključati - topla voda ili hladna? Opet je sve očigledno - prvi će na cilju biti onaj topli. Zašto sve ovo čudna pitanja i eksperimenti? Odrediti fizičku veličinu koja se zove "količina topline".
Količina toplote
Količina toplote je energija koju telo gubi ili dobija tokom prenosa toplote. To je jasno iz imena. Prilikom hlađenja tijelo će izgubiti određenu količinu topline, a pri zagrijavanju će apsorbirati. I odgovori na naša pitanja su nam pokazali Od čega zavisi količina toplote? Prvo, što više tjelesne mase, više toplote se mora potrošiti da se njena temperatura promeni za jedan stepen. Drugo, količina topline potrebna za zagrijavanje tijela ovisi o tvari od koje se sastoji, odnosno o vrsti tvari. I treće, razlika u tjelesnoj temperaturi prije i poslije prijenosa topline također je važna za naše proračune. Na osnovu gore navedenog, možemo odredite količinu topline koristeći formulu:
Q=cm(t_2-t_1) ,
gdje je Q količina toplote,
m - tjelesna težina,
(t_2-t_1) - razlika između početnog i konačnog telesne temperature,
c je specifični toplotni kapacitet supstance, koji se nalazi iz odgovarajućih tabela.
Koristeći ovu formulu, možete izračunati količinu topline koja je potrebna za zagrijavanje bilo kojeg tijela ili koju će ovo tijelo osloboditi pri hlađenju.
Količina topline se mjeri u džulima (1 J), kao i svaka vrsta energije. Međutim, ova vrijednost je uvedena ne tako davno, a ljudi su količinu topline počeli mjeriti mnogo ranije. I koristili su jedinicu koja se široko koristi u naše vrijeme - kaloriju (1 cal). 1 kalorija je količina toplote potrebna da se 1 gram vode zagreje za 1 stepen Celzijusa. Vođeni ovim podacima, oni koji vole da broje kalorije u hrani koju jedu mogu, samo radi zabave, izračunati koliko litara vode može da se prokuha sa energijom koju unose hranom tokom dana.
